上海金畔生物科技有限公司代理AAT Bioquest荧光染料全线产品,欢迎访问AAT Bioquest荧光染料官网了解更多信息。
Cell Meter 活细胞ATP检测试剂盒
 |
货号 | 23015 | 存储条件 | 在零下15度以下保存, 避免光照 |
| 规格 | 100 Tests | 价格 | 4224 | |
| Ex (nm) | Em (nm) | |||
| 分子量 | 溶剂 | |||
| 产品详细介绍 | ||||
简要概述
三磷酸腺苷(ATP)在细胞能量、代谢调节和细胞信号传导中起着基本作用。它被称为细胞内能量转移的“货币分子单位”,以驱动活细胞中的许多生物过程和化学合成。 ATP也是细胞通讯的信号分子,在DNA和RNA合成中起着重要作用。它位于发生细胞呼吸的线粒体中。 ATP水平可用于测量细胞增殖和细胞周期动态。 Cell Meter 活细胞ATP检测试剂盒使研究人员可以使用检测细胞ATP的渗透型红色荧光成像探针ATP Red 来检测活细胞中的ATP水平。 ATP Red 旨在检测活细胞线粒体中的ATP浓度。该探针与AMP,ADP,CMP,CDP,CTP,UMP,UDP,UTP,GMP,GDP或GTP的交叉反应性最小。
适用仪器
| 荧光酶标仪 | |
| 激发: | Cy3/TRITC滤波片组 |
| 发射: | Cy3/TRITC滤波片组 |
| 推荐孔板: | 黑色透明孔板 |
产品说明书
实验方案
概述
在生长培养基中准备细胞
将细胞与ATP Red 工作溶液在37°C下孵育15-30分钟
去掉ATP Red 工作溶液
使用Cy3 / TRITC滤波片组的荧光显微镜进行检测
准备细胞
对于贴壁细胞
在96孔板的生长培养基中以10,000至40,000个细胞/孔/ 90μL平板培养细胞过夜,而对于384孔板则以2,500至10,000个细胞/孔/ 20μL平板培养过夜。
对于悬浮细胞
离心培养液中的细胞,然后将细胞沉淀以50,000-100,000细胞/孔/ 90 µL的浓度悬浮于96孔聚D赖氨酸平板中,或10,000-25,000细胞/孔/ 20 / L以获得384孔中的悬浮液 聚-D赖氨酸板。 实验前,将板以800 rpm的速度离心2分钟。
注意:应该对每个细胞系进行单独评估,以确定最佳细胞密度。
溶液配制
除非另有说明,否则所有未使用的储备溶液应分为一次性使用的等分试样,并在制备后储存在-20°C下。 避免重复冻融循环。
ATP Red 储备溶液配制(500X)
将50 µL DMSO(组分C)添加到小瓶ATP Red (组分A)中,制成500X储备液。
注意:50 µL的500X ATP Red 储备溶液足以容纳一个96孔板。 可以将未使用的ATP Red 储备溶液分装,并在≤-20°C下以较小的等分试样存储。 避光,并避免重复的冻融循环。
ATP Red 工作溶液配制
将5 µL 500X储备溶液(组分A)添加到1 mL细胞培养基中,并充分混合。
注意:ATP Red 探针与我们检测的大多数细胞系的细胞培养基兼容。 可以根据特定的细胞类型修改染色条件。
操作步骤
1.在生长培养基中准备细胞。
2.在细胞板中加入等体积的[100 µL /孔(96孔板)或25 µL /孔(384孔板)]。
注意:ATP Red 的最佳浓度因具体应用而异。
3.在避光的条件下,将细胞在37°C下孵育15-30分钟。
4.从每个孔中除去工作溶液。 用测定缓冲液(组分B)或您选择的缓冲液洗涤细胞两次。
5.使用带有Cy3 / TRITC滤光片组的荧光显微镜观察细胞中的荧光信号。
图示
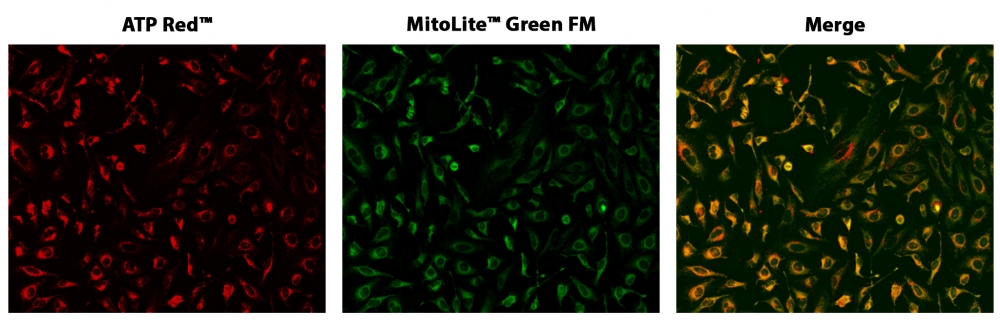
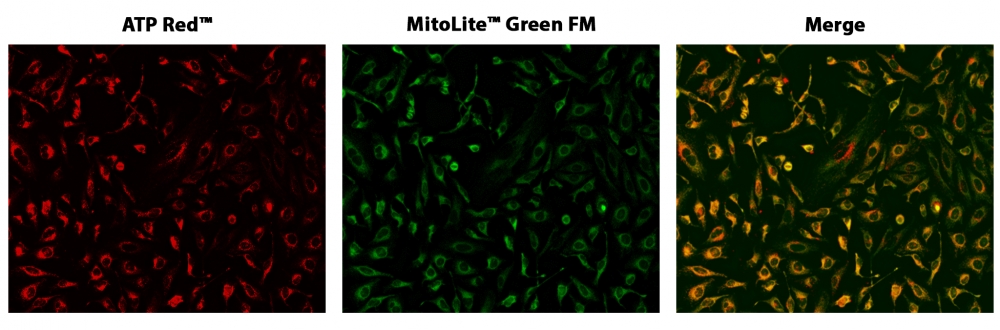
图1. HeLa细胞与ATP Red 和MitoLite Green FM共染色的荧光图像在96孔黑色透明底板。 HeLa细胞用ATP Red 染色15分钟,然后与100 nM MitoLite Green FM(Cat#22695)孵育30分钟。 成像前用测定缓冲液洗涤两次。 ATP Red 和MitoLite ATP Red 信号重叠良好。使用带有Cy3 / TRITC和FITC滤光片的荧光显微镜对细胞成像。
参考文献
Metabolic co-dependence of the oocyte and cumulus cells: essential role in determining oocyte developmental competence.
Authors: Richani, Dulama and Dunning, Kylie R and Thompson, Jeremy G and Gilchrist, Robert B
Journal: Human reproduction update (2021): 27-47
Mitochondrial C3a Receptor Activation in Oxidatively Stressed Epithelial Cells Reduces Mitochondrial Respiration and Metabolism.
Authors: Ishii, Masaaki and Beeson, Gyda and Beeson, Craig and Rohrer, Bärbel
Journal: Frontiers in immunology (2021): 628062
Cell-penetrating and mitochondrion-targeting molecules.
Authors: Appiah Kubi, George and Pei, Dehua
Journal: Methods in enzymology (2020): 311-328
Combinatorial roles of mitochondria and cGMP/PKG pathway in the generation of neuronal free Zn2+ under the presence of nitric oxide.
Authors: Yang, De-Ming and Huang, Chien-Chang and Chang, Yu-Fen
Journal: Journal of the Chinese Medical Association : JCMA (2020): 357-366
Dynamic regulation of subcellular mitochondrial position for localized metabolite levels.
Authors: Alshaabi, Haya and Heininger, Meara and Cunniff, Brian
Journal: Journal of biochemistry (2020): 109-117
Engineering a Reversible Fluorescent Probe for Real-Time Live-Cell Imaging and Quantification of Mitochondrial ATP.
Authors: Ren, Tian-Bing and Wen, Si-Yu and Wang, Lu and Lu, Peng and Xiong, Bin and Yuan, Lin and Zhang, Xiao-Bing
Journal: Analytical chemistry (2020): 4681-4688
Heat stress induces apoptosis through disruption of dynamic mitochondrial networks in dairy cow mammary epithelial cells.
Authors: Chen, Kun-Lin and Wang, Hui-Li and Jiang, Lin-Zheng and Qian, Yong and Yang, Cai-Xia and Chang, Wei-Wei and Zhong, Ji-Feng and Xing, Guang-Dong
Journal: In vitro cellular & developmental biology. Animal (2020): 322-331
Intracellular ATP levels influence cell fates in Dictyostelium discoideum differentiation.
Authors: Hiraoka, Haruka and Nakano, Tadashi and Kuwana, Satoshi and Fukuzawa, Masashi and Hirano, Yasuhiro and Ueda, Masahiro and Haraguchi, Tokuko and Hiraoka, Yasushi
Journal: Genes to cells : devoted to molecular & cellular mechanisms (2020): 312-326
Measurement of ATP concentrations in mitochondria of living cells using luminescence and fluorescence approaches.
Authors: Morciano, Giampaolo and Imamura, Hiromi and Patergnani, Simone and Pedriali, Gaia and Giorgi, Carlotta and Pinton, Paolo
Journal: Methods in cell biology (2020): 199-219
Mitochondria transfer enhances proliferation, migration, and osteogenic differentiation of bone marrow mesenchymal stem cell and promotes bone defect healing.
Authors: Guo, Yusi and Chi, Xiaopei and Wang, Yifan and Heng, Boon Chin and Wei, Yan and Zhang, Xuehui and Zhao, Han and Yin, Ying and Deng, Xuliang
Journal: Stem cell research & therapy (2020): 245
