上海金畔生物科技有限公司代理AAT Bioquest荧光染料全线产品,欢迎访问AAT Bioquest荧光染料官网了解更多信息。
Amplite 过氧化物和过氧化酶近红外荧光底物
 |
货号 | 11009 | 存储条件 | 在零下15度以下保存, 避免受潮, 避免光照 |
| 规格 | 1 mg | 价格 | 1272 | |
| Ex (nm) | 648 | Em (nm) | 668 | |
| 分子量 | ~400 | 溶剂 | DMSO | |
| 产品详细介绍 | ||||
简要概述
Amplite 过氧化物和过氧化酶近红外荧光底物是美国AAT Bioquest生产的用于检测过氧化氢的荧光探针,我们的Amplite IR是一种荧光性过氧化酶底物,与过氧化酶和H2O2反应时,产生近红外荧光。它可以用来检测H2O2和过氧化酶。Amplite IR产生的物质在647nm处具有最大吸收峰,同时在647nm处有最大发射峰。这种近红外吸收和荧光将检测的本底降至最小,这些本底经常由自我吸收和/或生物样品自身的荧光,但是在600nm附近自身光吸收基本没有。金畔生物是AAT Bioquest的中国代理商,为您提供最优质的Amplite 过氧化物和过氧化酶近红外荧光底物。
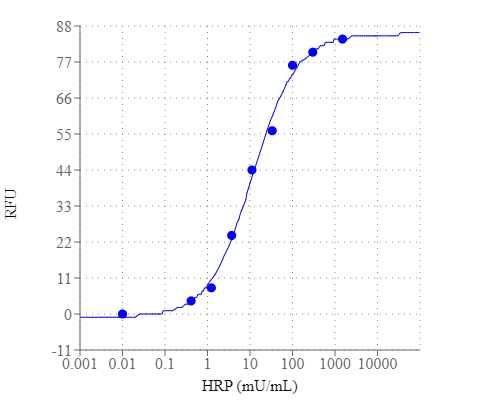
点击查看光谱
适用仪器
| 荧光酶标仪 | |
| 激发: | 640nm |
| 发射: | 680nm |
| cutoff: | 650nm |
| 推荐孔板: | 黑色底板 |
产品说明书
样品实验方案
简要概述
1.制备100μMAmplite IR 0.8 U / ml的过氧化物酶在磷酸盐缓冲液,并在孔中加入50微升
2.添加H 2 O 2标准品或测试样品(50μL)
3.在室温下孵育0-30分钟
4.监测Ex / Em = 640 / 680nm处的荧光强度
溶液制备
1.储备溶液
所有未使用的储备溶液应分成一次性等分试样,并在制备后储存在-20°C。避免反复冻融循环。
1.1Amplite IR原液:
加入适量无水DMSO,制成10至25 mM Amplite IR原液。
2.工作溶液
Amplite IR工作溶液(2X):
为了在50 mM磷酸盐缓冲液或您选择的缓冲液中达到每孔50至100μM的最终浓度,在管中制备100至200μM浓度的溶液。每孔需要50μL。 注意:在硫醇如DTT和b-巯基乙醇存在下,Amplite IR不稳定。高于10μM(最终浓度)的硫醇可显着降低测定动态范围。NADH和谷胱甘肽(从GSH中还原)可能会干扰测定。注意:我们建议您每次进行实验时都使用新鲜原液。
操作步骤
1.在上清液中进行H2O2测定
1.1将50μL的2X Amplite IR工作溶液(来自步骤1.2)添加到H 2 O 2标准品,空白对照和测试样品的每个孔中,以使总H2O2测定体积为100μL/孔。注意:对于384孔板,每孔加入25μL样品和25μL2XAmplite IR工作溶液。
1.2在室温下孵育反应0至30分钟,避光。
1.3使用荧光板读数器监测Ex / Em = 640 / 680nm处的荧光增加。 注意:Amplite IR过氧化物酶底物易于自氧化,因此一旦加入H2O2反应混合物就读取荧光,以提高信噪比。
1.4空白孔中的荧光(仅使用测定缓冲液)用作对照,并从具有H2O2的那些孔的值中减去。
2.运行H2O2测定法的细胞:
2.1Amplite IR可用于测量细胞中H2O2的释放。以下是建议的方案,可根据您的具体研究需要进行修改.Dipite IR工作溶液应按步骤1.2制备,但磷酸盐缓冲液应替换为细胞培养系统中使用的培养基。建议的培养基包括(a)Krebs Ringers磷酸盐缓冲液(KRPB); (b)中。汉克斯平衡盐溶液(HBSS); 或(c)无血清培养基。
2.2在96孔板(50-100μL/孔)中制备细胞,并根据需要激活细胞。 注意:包括阴性对照(单独培养基和非活化细胞)用于测量背景荧光。
2.3加入50微升H2O2反应混合物至细胞的每个孔中,注意:对于384孔板中,添加25μL细胞和25微升H2O2反应混合物倒入每个孔。
2.4在室温下孵育反应0至30分钟,避光。
2.5使用荧光板读数器监测Ex / Em = 640 / 680nm处的荧光增加。 注意:也可以将板的内容物转移到白色透明底板上,并用吸光度酶标仪在670nm波长下读数。与荧光读数相比,吸收检测具有较低的灵敏度。 注意:荧光背景随时间增加,因此减去每个数据点的空白孔的荧光强度值是很重要的。
参考文献
Assessment of Tofacitinib and Ruxolitinib and their Anti Inflammatory Effects on Myeloperoxidase
Authors: Amber Milton
Journal: (2017)
Patterned Photonic Nitrocellulose for Pseudo-Paper ELISA
Authors: Junjie Chi, Bingbing Gao, Mi Sun, Fengling Zhang, Enben Su, Hong Liu, Zhongze Gu
Journal: Analytical Chemistry (2017)
Spinal Cord Inflammation: Molecular Imaging after Thoracic Aortic Ischemia Reperfusion Injury
Authors: Hassan Albadawi, John W Chen, Rahmi Oklu, Yue Wu, Gregory Wojtkiewicz, Benjamin Pulli, John D Milner, Richard P Cambria, Michael T Watkins
Journal: Radiology (2016): 152222
Myeloperoxidase Nuclear Imaging for Epileptogenesis
Authors: Yinian Zhang, Daniel P Seeburg, Benjamin Pulli, Gregory R Wojtkiewicz, Lionel Bure, Wendy Atkinson, Stefan Schob, Yoshiko Iwamoto, Muhammad Ali, Wei Zhang
Journal: Radiology (2015): 822–830
Myeloperoxidase–Hepatocyte–Stellate Cell Cross Talk Promotes Hepatocyte Injury and Fibrosis in Experimental Nonalcoholic Steatohepatitis
Authors: Benjamin Pulli, Muhammad Ali, Yoshiko Iwamoto, Matthias WG Zeller, Stefan Schob, Jenny J Linnoila, John W Chen
Journal: Antioxidants & redox signaling (2015): 1255–1269
Ordered cleavage of myeloperoxidase ester bonds releases active site heme leading to inactivation of myeloperoxidase by benzoic acid hydrazide analogs
Authors: Jiansheng Huang, Forrest Smith, Peter Panizzi
Journal: Archives of biochemistry and biophysics (2014): 74–85
Raising the shields: PCR in the presence of metallic surfaces protected by tailor-made coatings
Authors: Frank D Scherag, Thomas Brandstetter, Jürgen Rühe
Journal: Colloids and Surfaces B: Biointerfaces (2014): 576–582
Measuring myeloperoxidase activity in biological samples
Authors: Benjamin Pulli, Muhammad Ali, Reza Forghani, Stefan Schob, Kevin LC Hsieh, Gregory Wojtkiewicz, Jenny J Linnoila, John W Chen
Journal: PLoS One (2013): e67976
Micro-volume wall-less immunoassays using patterned planar plates
Authors: Katherine R Kozak, Jianyong Wang, Melvin Lye, Rashi Takkar, Namyong Kim, Hyunjae Lee, Noo Li Jeon, Kedan Lin, Crystal Zhang, Wai Lee T Wong
Journal: Lab on a Chip (2013): 1342–1350
Distinguishing inflammation from tumor and peritumoral edema by myeloperoxidase magnetic resonance imaging
Authors: Anne Kleijn, John W Chen, Jason S Buhrman, Gregory R Wojtkiewicz, Yoshiko Iwamoto, Martine L Lamfers, Anat O Stemmer-Rachamimov, Samuel D Rabkin, Ralph Weissleder, Robert L Martuza
Journal: Clinical Cancer Research (2011): 4484–4493